QUIMICA pH base debil grado disociacion iones del NH3 AULAEXPRESS UNIVERSIDAD YouTube

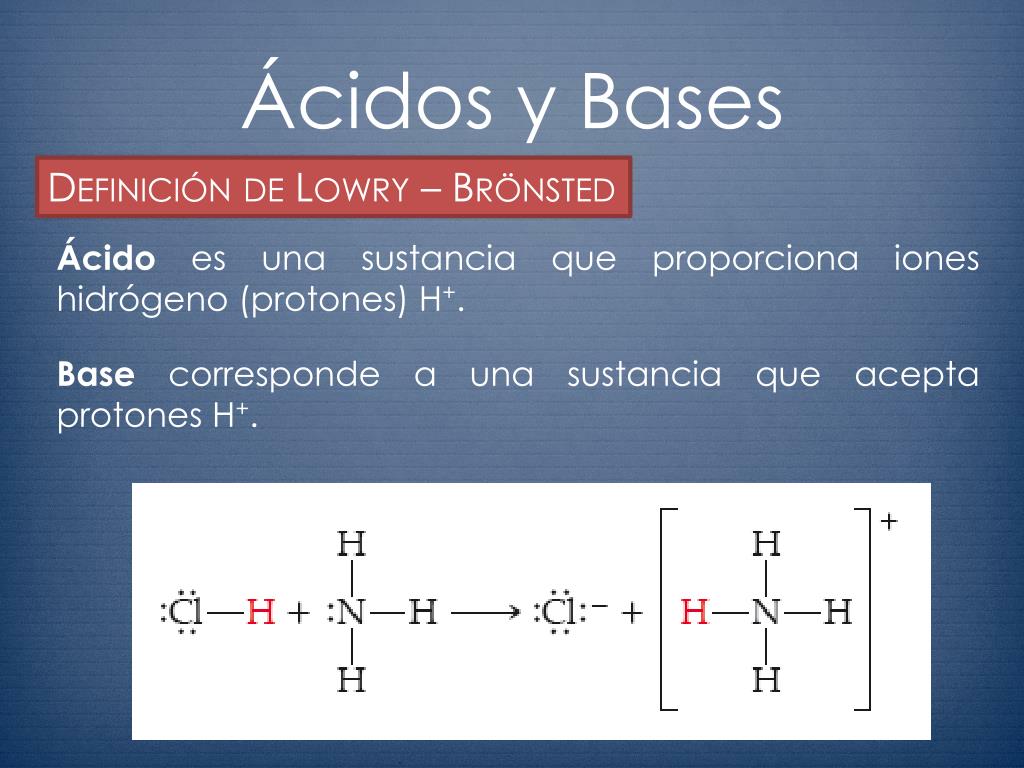
Identificar bases y ácidos de Brønsted-Lowry. En la reacción entre el agua y el ácido nítrico, el ácido nítrico, HNO 3 , dona un protón (en azul) al agua, de tal forma que actúa como un ácido de Brønsted-Lowry. H NO 3 ( a c) + H 2 O ( l) → H 3 O + ( a c) + NO 3 − ( a c) Puesto que el agua acepta el protón del ácido nítrico.
Calcular el pH de una solución de amoníaco YouTube

The posting of any external links (URLS) is strictly forbidden, this also includes private - (giving out your user id for offsite -). 5. No spamming, flooding, phishing. 6. KIK, DISCORD, TELEGRAM, SNAPCHAT etc usernames/urls will result in instant ban. [PRIVATE TRADING IS PROHIBITED] Share on the board. 7.
Sintesis de Acido Nitrico , Amoniaco (Original) Amoníaco Ácido nítrico

El amoníaco se considera una base débil porque su átomo de nitrógeno puede aceptar fácilmente un protón. Cuando se disuelve en agua, el amoníaco toma iones de hidrógeno del agua y forma iones hidróxido y amonio. La presencia de iones hidróxido le da al amoníaco sus propiedades básicas. Existen algunos compuestos químicos bien.
Limao é Acido Ou Base
Amoníaco, con la fórmula química NH3, es un compuesto que consta de un átomo de nitrógeno y tres átomos de hidrógeno. Se utiliza comúnmente en diversas industrias, incluida la agricultura, los productos de limpieza y la refrigeración. En agua, el amoníaco exhibe propiedades tanto de ácido como de base.
Quimica de 5to del norte Equilibrio ácidobase en imágenes

Tales reacciones ácido-base son siempre exotérmicas y podemos medir el cambio de temperatura y calcular el cambio de entalpía correspondiente ( ΔH Δ H) para la reacción. Independientemente del ácido fuerte o base fuerte que elijas, el cambio de entalpía es siempre el mismo (aproximadamente 58 kJ/mol 58 k J / m o l de H2O H 2 O producido).
Amoníaco (NH3) Conceito e o que é
Los elementos más electronegativos forman hidruros covalentes que generalmente reaccionan como ácidos, siendo un ejemplo bien conocido el cloruro de hidrógeno, un gas que se disuelve fácilmente en agua para dar la solución que conocemos como ácido clorhídrico. HCl(g) +H2O(l) → H3O+ + Cl- (10.6.2) (10.6.2) H C l ( g) + H 2 O ( l) →.
Amoniaco estructura quimica fotografías e imágenes de alta resolución Alamy
Propiedades Físicas y Químicas. El amoníaco es más ligero que el aire, lo que le permite elevarse y dispersarse rápidamente. Es soluble en agua, y su solución acuosa es conocida como amoníaco líquido. En su forma pura, tiene un punto de ebullición de -33.34°C y un punto de fusión de -77.73°C. Es una base fuerte y tiene la tendencia.
Acido Amoniaco

Transcripción. Para la titulación de una base débil con un ácido fuerte, la curva de pH es inicialmente básica y tiene un punto equivalencia ácido (pH < 7). La sección de curva entre el punto inicial y el punto de equivalencia se conoce como región amortiguadora. En el punto de equivalencia media, las concentraciones de los componentes.
¿Cómo se forman los Ácidos, Bases y Sales?
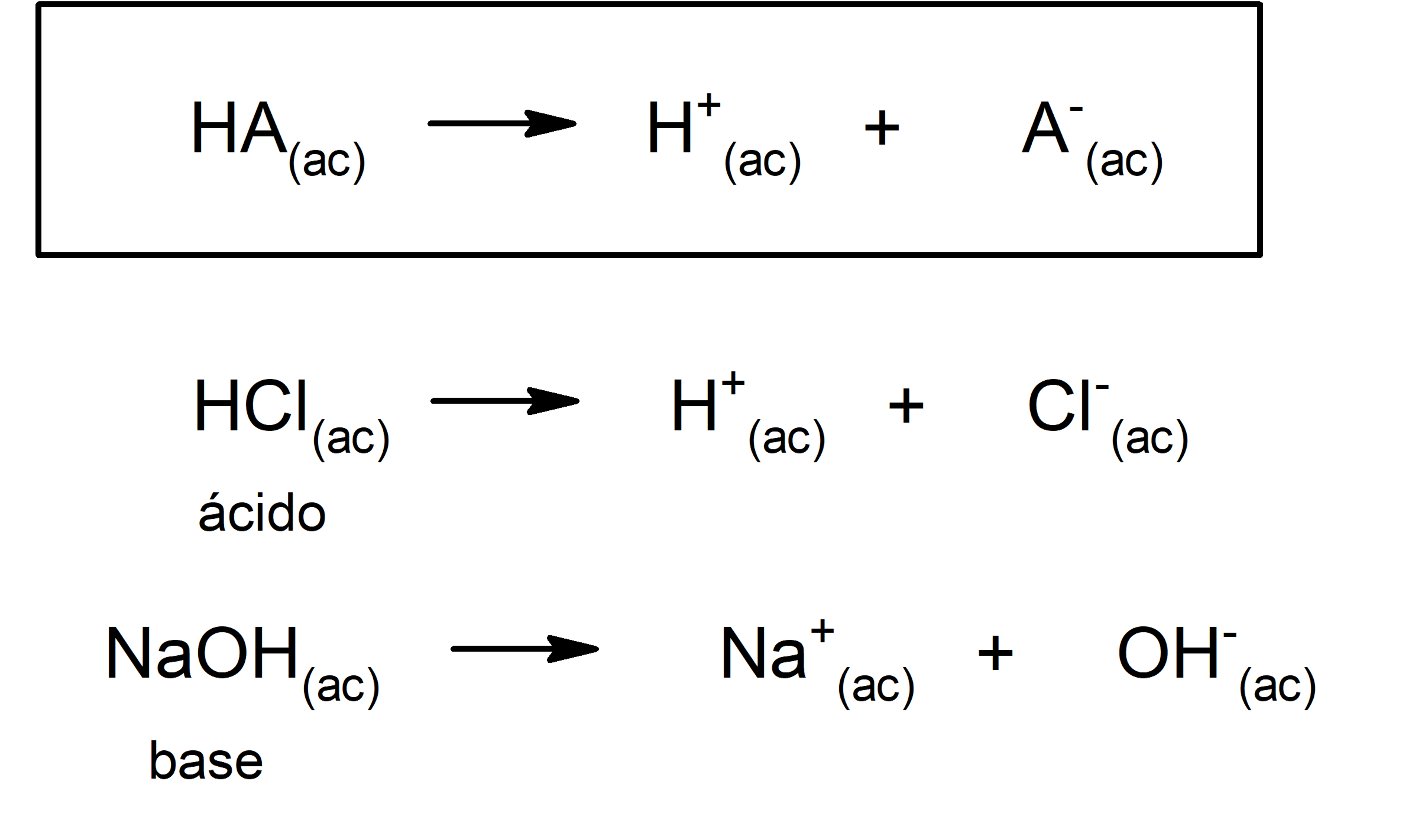
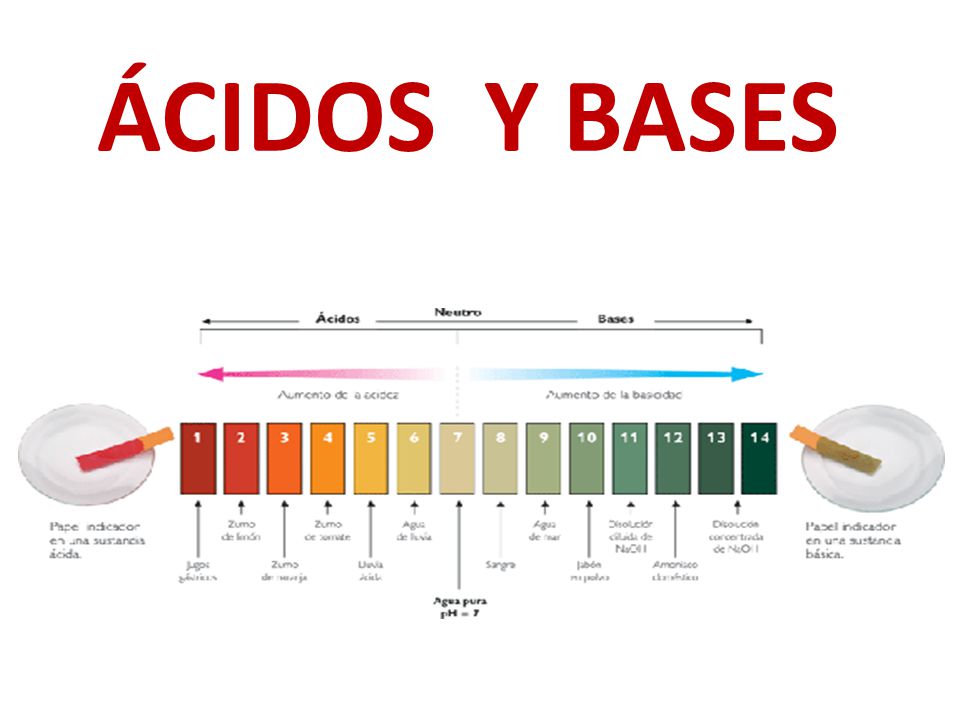
Ácidos y bases. Las soluciones se clasifican como ácidas o básicas de acuerdo con su concentración de iones hidrógeno relativa al agua pura. Las soluciones ácidas tienen una concentración de H + mayor que el agua (mayor a 1 × 10 − 7 M), mientras que las soluciones básicas (alcalinas) tienen una concentración de H + menor (menor a 1.
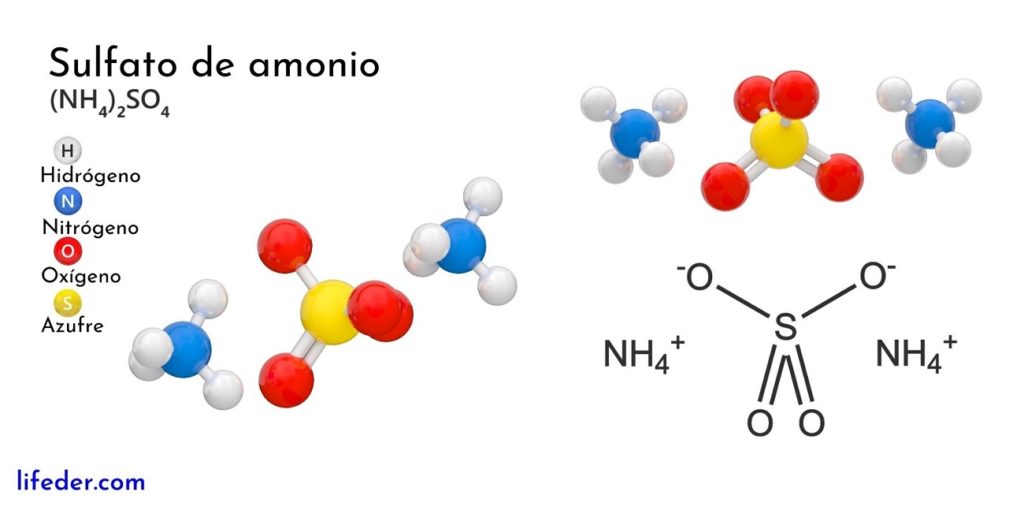
Catión de amonio, NH4 y amoniaco, molécula NH3. Fórmula química estructural y modelo de molécula

El amoníaco, amoniaco, 5 6 azano, espíritu de Hartshorn, trihidruro de nitrógeno o gas de amonio es un compuesto químico de nitrógeno con la fórmula química NH 3. Es un gas incoloro con un característico olor repulsivo. El amoníaco contribuye significativamente a las necesidades nutricionales de los organismos terrestres por ser un.
Tabla Acido Y Bases

Los ácidos de Arrhenius. La teoría de ácidos y bases de Arrhenius fue propuesta originalmente por el químico sueco Svante Arrhenius en 1884, quien sugirió clasificar ciertos compuestos como ácidos o bases de acuerdo con el tipo de iones que se forman cuando el compuesto se añade al agua. Los cítricos, como la toronja, contienen altas.
REACCIONES ÁCIDOBASE Página web de antoniofisicayquimica
El amoníaco: una base esencial en la química. El amoníaco es una base esencial en la química debido a su amplio uso en diversas aplicaciones industriales y científicas. Es un compuesto químico incoloro con una fórmula molecular de NH3, compuesto por un átomo de nitrógeno y tres átomos de hidrógeno. Una de las principales aplicaciones.
PPT Equilibrio Ácido Base PowerPoint Presentation, free download ID5978166
El amoníaco base fuerte es una solución de amoníaco en agua que contiene una gran cantidad de iones hidróxido (OH-). Debido a la presencia de estos iones, el amoníaco base fuerte es muy alcalino con un pH de aproximadamente 11.5. El amoníaco base fuerte es útil en la limpieza de superficies muy sucias, como las paredes del baño o la cocina.
Formula Quimica Del Amoniaco Ripo
Amoníaco. El amoníaco es un compuesto inorgánico de nitrógeno e hidrógeno con la fórmula NH3< /lapso>. Un hidruro binario estable y el hidruro de pnictógeno más simple, el amoníaco es un gas incoloro con un olor acre distintivo. Biológicamente, es un desecho nitrogenado común, particularmente entre los organismos acuáticos, y.
Equilibrio AcidoBase Mind Map

En la reacción del amoníaco con agua para dar iones amonio e iones hidróxido (Ecuación 16.1.3), el amoníaco actúa como base al aceptar un protón de una molécula de agua, lo que en este caso significa que el agua está actuando como un ácido.En la reacción inversa, un ion amonio actúa como un ácido donando un protón a un ion hidróxido, y el ion hidróxido actúa como base.
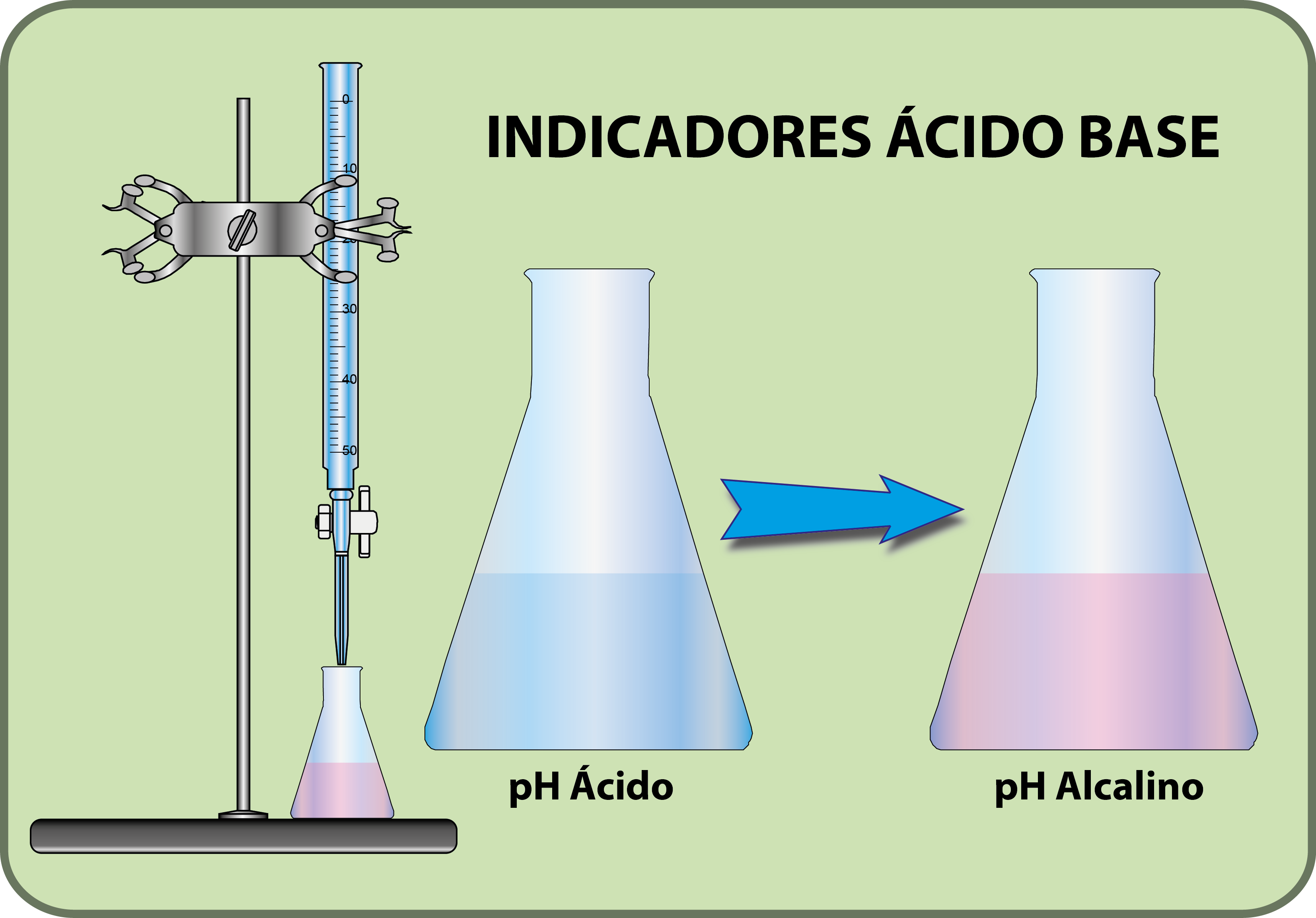
¿Qué es un indicador ácido base? Funcionamiento y ejemplos YuBrain
El amoníaco, una molécula compuesta por nitrógeno e hidrógeno (NH3), se revela como una sustancia química de profundo interés y versatilidad en diversos campos. Esta compuesto gaseoso, con un característico olor pungente, despliega una relevancia notable en la industria, la agricultura y la química, sirviendo como materia prima.